黄色ブドウ球菌菌血症(Staphylococcus aureus bacteremia: SAB)は日常診療で遭遇する機会は多く、致死率も約25%と高い疾患です。またMRSA(メチシリン耐性黄色ブドウ球菌)感染症に関するガイドラインはあるものの、SABのガイドラインはありません。ではSABではどのようなマネジメントが求められるのでしょうか?
今回American Journal of MedicineにSABのレビューが出ており、非常にわかりやすかったのご紹介します。
SABのマネジメントで重要なのは下記5つです。
- 適切な抗菌薬療法
- 心臓超音波の実施
- 転移病巣の評価やソースコントロール
- 適切な抗菌薬投与期間
- 感染症科へのコンサルテーション
また、SABのマネージメントのフローチャートになります。SABに遭遇した際に確認してください。
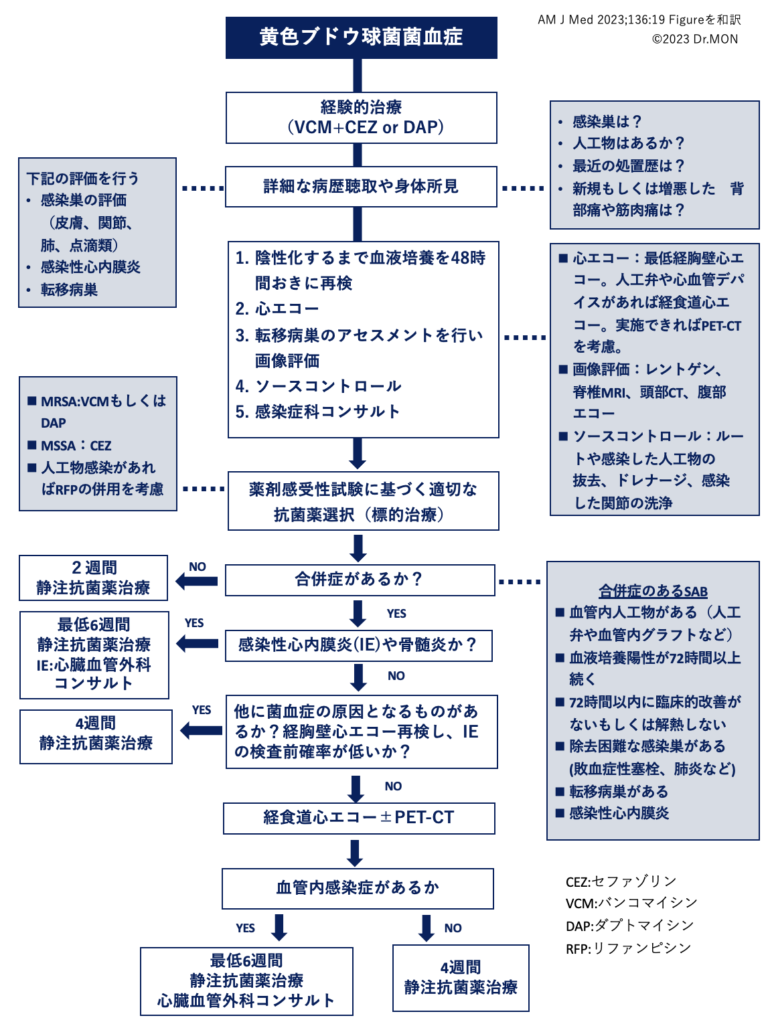
1. 適切な抗菌薬治療
経験的治療 empiric therapy
SABにおける抗菌薬の選択は重要です。MSSA(メチシリン感受性黄色ブドウ球菌)菌血症におけるバンコマイシン単剤療法は、抗黄色ブドウ球菌βラクタム系抗菌薬と比較して臨床転帰を悪化させることが知られています。そのためMRSAかMSSAかわからな場合は、抗黄色ブドウ球菌用βラクタム系抗菌薬と抗MRSA薬を併用して治療すべきです。
MSSA菌血症
- セファゾリンや抗黄色ブドウ球菌用ペニシリン(日本にはない)の投与が望ましい。
- セファゾリンと抗黄色ブドウ球菌用ペニシリンの治療効果は同等だが、抗黄色ブドウ球菌用ペニシリンは間質性腎炎の発生率が高い。
- 中枢移行性に関しては、セファゾリンに比べ抗黄色ブドウ球菌用ペニシリンが優れていると考えられていましたが、近年薬物動態学の観点から中枢神経病変を有するSABにおいてもセファゾリンが有効な選択肢となりうることが注目されています。
- ピペラシリン/タゾバクタムや非第一世代セファロスポリンもMSSAに活性を有しますが、死亡率の上昇および予後の悪化と関連しています。発熱性好中球減少症や混合感染の場合はその限りではありませんが、感染症専門医との相談が望ましい薬剤です。
MRSA菌血症
- バンコマイシンもしくはダプトマイシンの投与が望ましい。
- バンコマイシンは、従来のトラフ値(15-20mg/L)ではなく、AUC/MICにて400-600mg/h/Lにすることが推奨されます。
- バンコマイシンの限界が認識されるようになりダプトマイシンが使用される傾向にあります。ダプトマイシンはSABにおける治療効果はバンコマイシンに非劣勢で、バンコマイシンのMIC≧2の株ではダプトマイシンが勝る可能性があります。
- リネゾリドは、髄膜炎、皮膚軟部組織感染症、肺炎に使用されますが、菌血症ではダプトマイシンやバンコマイシンと比較して死亡率が高くなることが報告されています。
新規薬剤
- CeftarolineとCefobiproleは第5世代のセファロスポリンとして、MRSAによる皮膚軟部組織感染症や肺炎の治療薬として米国にて承認されています(両薬とも日本では未承認)。
- SABによる右心系感染性心内膜炎(IE)に対してフルオロキノロン+リファンピンがバンコマイシンと同等という報告もあります。ST合剤、テトラサイクリン、クリンダマイシン、経口βラクタム薬はエビデンス不足。
- リネゾリド、またはフルオロキノロン+リファンピンの使用は他の選択肢が使用不可能な場合のサルベージ療法としてのみ推奨されます。
2. 心臓超音波の実施
- 欧州心臓病学会ならびに米国感染症学会では、SABにおいて心臓超音波を実施することが推奨されています。
- SABのIEの18%は臨床的兆候を示しません。
- 経食道心臓超音波(TEE)は経胸壁心臓超音波(TTE)に比べて感度は高いが、特異度は両者とも変わりません。TEEは人工弁や心臓内デバイスがある患者で推奨されます。
- 合併症のあるSABにより6週間以上の抗菌薬治療を必要とする患者では、IEの手術適応を考慮する場合を除いてTEEを必ずしも受ける必要はありません。
- 心臓MRI、心臓CT、PET-CT、CTアンギオグラフィーは心臓超音波の代替検査となります。例えば、CTアンギオグラフィーは、膿瘍や感染性動脈瘤をTEEと同程度の診断精度で検出できる他、弁周囲の評価、大動脈や冠動脈の解剖学的特徴を明らかにし、術前評価に有用となります。(→この辺りは2023年に改訂された、欧州心臓病学会のIEのガイドラインや、新しくなったDuke基準(Duke-ISCVID)にも載っていますね)
- 治療終了時の心臓超音波検査の実施に関する推奨事項はないが、再発リスクが大きいIE症例を選んで心エコー検査を実施することを推奨しています。これはIEの治療終了後にも弁に疣腫が残存することが一般的であることから、IE再発の疑いが高い場合は、将来のTTEと比較することができためです。
3. 転移病巣とソースコントロール
- SABの感染巣や合併症を特定することは診断や治療に有用です。
- 最近の処置や外傷、基礎疾患を問うことで感染巣が推測できます。
- 転移巣や予後は、感染巣によっても異なります。
- 一般的なSABの感染巣はカテーテル関連血流感染もしくは皮膚軟部組織感染症です。
- SABの40%以上は明らかな感染巣は特定できません。
- 尿路感染は稀であり、尿培養で黄色ブドウ球菌を認めた場合は、血行性播種の結果を反映している可能性があります。
- SABと尿培養で黄色ブドウ球菌の両方を認める患者の5人に1人は椎体炎もしくは腸腰筋膿瘍を合併しています。
- SAB では関節や脊椎、臓器への播種が一般的であり丁寧な診察を行い必要に応じて画像検査が必要です。
- 激しい頭痛があれば心内膜炎からの塞栓を疑い、関節炎があれば関節穿刺を行うべきです。
- 椎間板炎は一般的な背部痛として認識されてしまうことがあるため、椎骨の圧痛は必ず確認すべきです。症状が軽微であっても脊椎MRIを行うべきです。レントゲンの変化は症状から10日遅れて出現するためMRIが望ましい。
- PET-CTは、検査前確率が高いにも関わらずルチンの心エコーなどで病巣を検出できない時などSABの転移性病巣を検索するために利用されることが増えています。白血球スキャンは、骨髄内に白血球が取り込まれるため、椎間板炎症例をのぞいて塞栓症状を評価する役割を持ちます。
- SABのソースコントロールは菌血症の解除やそれに関する死亡率を低下させます。
- 中心静脈カテーテルや心臓内デバイスなどは可能な限り抜去すべきです。
- SABがあり、人工弁や人工血管がある患者では感染の有無を調べる必要があります。
- 骨関節の金属など非血管内の異物は検査で指摘されない限り、検査は必要ありません。
- 敗血症性関節炎や硬膜外膿瘍を認めた場合は外科的処置が必要です。
- 筋肉内や腹腔内の播種症例では外科的ドレナージやCTガイド下ドレナージが必要です。
- すべのSABのIE症例において心臓血管外科の診察が重要です。
4. 適切な抗菌薬投与期間
- 血液培養にて菌の陰性化の確認が重要です。
- 少なくとも血液培養が陰性化してから2週間は抗菌薬投与が必要です。ただしこれは合併症がない場合に限ります。
- 合併症のないSABの定義に関しては様々な定義がなされていますが、最近の文献やエキスパートオピニオンとして著者らは、下記を挙げています。
- 治療開始後48-72時間以内に血液培養の陰性化確認でき、臨床的に改善していること
- 感染巣のソースコントロールができていること
- 転移病巣がないこと
- 血管内異物がないこと
- 心臓超音波で疣腫がみられないこと
- これらを満たさない場合は合併症ありと見なされ、血液培養陰性化から4週間の治療が必要です。またIEなどの合併症がある場合は6週間必要となります。
5. 感染症科へのコンサルテーション
- 感染症科による診察は予後の改善と関連しています。
- SABでは全例感染症科へのコンサルテーションが推奨されます。感染症科医の診察はレガシー効果(長期にわたるポジティブな影響)があり5年のアウトカム改善が見られます。
- 死亡率の減少は電話診察よりもベッドサイドで行った方が低い。
- ただし感染症科医にコンサルトを行うことが予後改善につながるメカニズムは不明です。
論文のまとめは以上になります。
感染症科や総合診療科が活躍している医療機関では概ねこれらのことは遵守されているかと思いますが、合併症のあるSABに関しては文献によっても異なっていたり(糖尿病患者が入っていたり・・・)して抗菌薬の投与期間については迷うこともありましたが、このレビューにおける定義は臨床医としては同意できるものと感じました。
個人的には、(可能なソースコントールした上でも)SABが持続する際の抗菌薬療法についてのデータが出るといいなと思っています。
The Golden Grapes of Wrath −Staphylococcus aureus Bacteremia: A Clinical Review. Am J Med 2023;136:19. PMID: 36179908.



コメント