臨床現場でしばしば遭遇するAmpC。よく聞くけれどよくわからない、うまく説明できないという方もいらっしゃるのではないでしょうか。今回はこのAmpCについて解説します。
AmpCに関する臨床上のポイントは、
“Enterobacter属菌、Klebsiella aerogenes, Citrobacter freundiiが薬剤感受性でCTXやCTRXに対して”S(感性)”の場合、第3世代セフェムを使用するのは原則避ける”
です。
AmpCβラクタマーゼとは
AmpCは、βラクタマーゼの一種で微生物が産生する酵素です。このβラクタマーゼは、βラクタム環を加水分解(壊す)します。
ちなみにβラクタム環とは、臨床的によく使われるペニシリン系、セフェム系、カルバペネム系、モノバクタムが持つ構造の一部で、細菌の細胞壁合成の最終段階に関与する酵素群のペニシリン結合蛋白(PBP)のトランスペプチダーゼ活性を阻害することにより抗菌作用を発揮します。
ですのでβラクタマーゼは細菌が抗菌薬(βラクタム環)から身を守るための武器の一つと言えます。AmpCβラクタマーゼは、ペニシリン系から第3世代セフェム系、セファマイシンまで幅広く分解します(=耐性)。2023年11月現在、日本で発売されているβラクタマーゼ阻害剤には、クラブラン酸(商品名:オーグメンチン、クラバモックス)、スルバクタム(同:ユナシン)、タゾバクタム(同:ゾシン、ザバクサ)、レレバクタム(同:レカルブリオ)がありますが、AmpCを阻害できるのはレレバクタムのみとなっています。
誘導耐性と脱抑制
AmpCβラクタマーゼは耐性遺伝子の存在部位により、染色体性とプラスミド性にわけられます。
プラスミド性の場合は、恒常的にAmpC発現が活性化されていて、薬剤感受性試験上第3世代セフェムは耐性となっています(薬剤感受性試験の結果を額面通りに受け取れる)。
問題は、染色体性で誘導耐性のパターンと脱抑制のパターンです。これらは薬剤感受性上は第3世代セフェムに感性を示しますが、このパターンではある種の抗菌薬に曝露される中で当初感受性を示していたセフトリアキソンなどが非感受性を示してしまいます。この2つの機序について解説します。
1. 誘導耐性
誘導耐性は、通常AmpC産生を抑制するAmpRの活性の低下によって生じます。βラクタム系抗菌薬の中にはAmpRに結合してコンフォーメンション変化を起こさせるものがあり(誘導能が高い)、AmpCの抑制が解除され、AmpCβラクタマーゼの産生が増加し、βラクタム薬に対する感受性が低下します。下記の表のようにペニシリン系や低世代のセフェムは誘導能が高いため、これらを使用するとAmpCが誘導されます。
| AmpC誘導能が高い | AmpC誘導能が低い | |
| AmpCに分解されやすい基質 | アンピシリン、第一世代セフェム、第二世代セフェム | セフタジジム、セフトリアキソン、セフォタキシム、ピペラシリン、アズトレオナム、タゾバクタム、スルバクタム |
| AmpCに分解されにく基質 | イミペネム | セフェピム、メロパネム |
2. 脱抑制
染色体上のAmpCの発現を調整している遺伝子(AmpR、AmpD)が存在するため、AmpCは低いレベルに抑制されていますが、一部この調整遺伝子に変異を持つ株が存在しています(下図:JAC 2018 Figure1参照)。そのため、AmpCが恒常的に産生されているこの変異株が混在している中で第三世代セフェムを使用すると変異株が選択されて増殖してしまい、最終的に第三世代セフェムが無効となってしまいます。下図のEnterobacter cloacae comlexはMorganella morganiiよりもこの変異株の割合が1,000倍多いということになります。
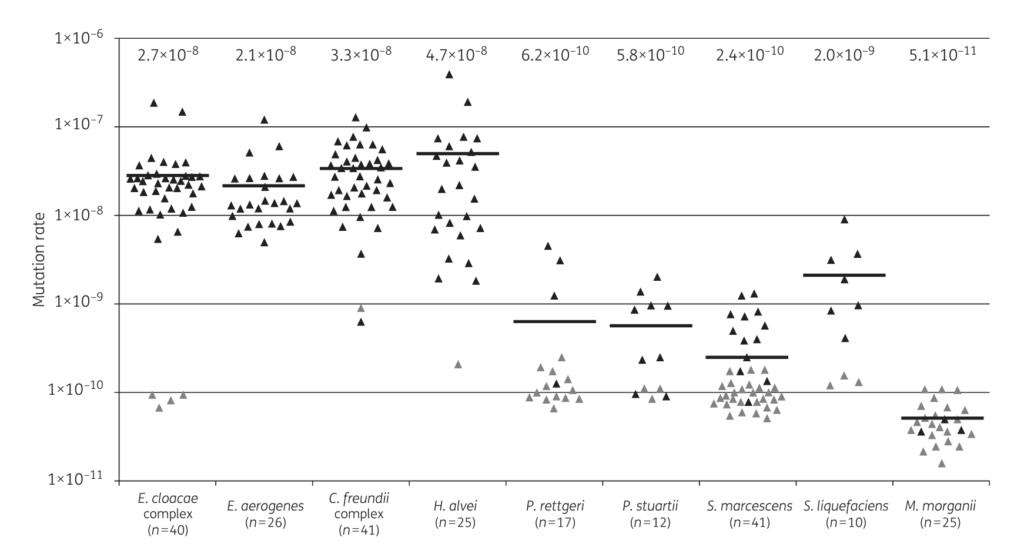
AmpCβラクタマーゼを持つ微生物
AmpC産生を誘導するリスクのあるグラム陰性桿菌は、Enterobacter cloacae complex、Klebsiella aerogenes、Citrobacter freundii、Serratia marcescens、Morganella morganii, Hafnia alveiが代表的な菌です。一方で、同じCitrobacterでもC. koseriやC. amalonaticusはAmpCを染色体上に持っていません。
IDSAのグラム陰性菌の治療ガイドでは、臨床的に重要なAmpC産生菌はEnterobacter cloacae complex、Klebsiella aerogenes, Citrobacter freundiiの3つといっていますので、まずはこの3菌種を覚えておくと良いと思います。
一般的に医療関連感染の原因微生物と絡めてSPACE(Serratia、Providencia/Pseudomonas、Acinetobacter、Citrobacter、Enterobacter)という略号が用いられていますが、これらは同じ属や種間でもAmpC誘導リスクは異なります。そのため、AmpC産生菌の覚え方はHECK Yesに変更しようという海外の記事(https://www.idstewardship.com/heck-yes-get-amped-updates-ampc-harboring-bacteria/)もありました(Hafnia alvei, Enterobacter cloacae, Citrobacter freundii, Klebsiella aerogenes, Yersinia enterocolitica)。
また脱抑制が起きても薬剤感受性は菌によっても違ったりします(下図: JAC2018 Fig2 黒: 感性、グレー: 中間耐性)。
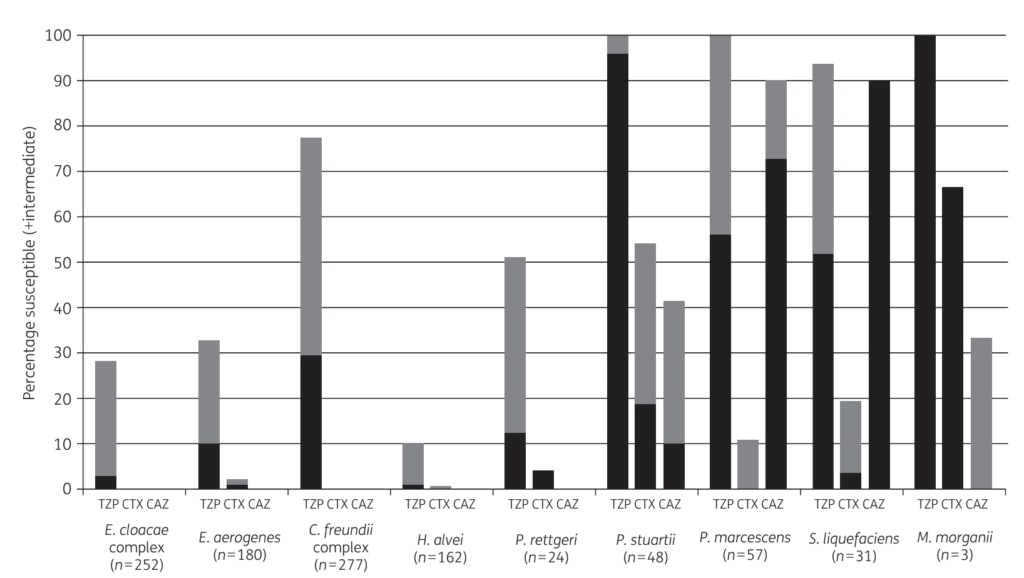
例えば脱抑制が起きた場合、ピペラシリン/タゾバクタムに関してはE. cloacae complexではほとんどが中間耐性ですが、M. morganiiはほぼ感性と報告されています。
AmpC産生菌の治療
それでは治療はどうしたら良いかということになりますが、基本的には、誘導能が低く、AmpC に分解されにくい、メロペネムやセフェピムが第一選択となります。
IDSA2023のガイドによれば、
セフトリアキソンに関しては、臨床的に重要なAmpC産生菌(Enterobacter cloacae、Klebsiella aerogenes, Citrobacter freundii)による侵襲性感染症では治療は推奨されず、単純性膀胱炎には使用しても良いという記載となっています。
ピペラシリン/タゾバクタムは、AmpC産生の腸内細菌目細菌による重症感染症の治療には推奨されていません。
ST合剤は単純性膀胱炎に対して、アミノグリコシドは単純性膀胱炎、腎盂腎炎、複雑性尿路感染症治療の代替薬として挙げられています。ST合剤やフルオロキノロンは侵襲性感染症の治療としても考慮されます。
AmpC産生菌に対する第三世代セフェムの使用に関しては、専門医の中でも意見が分かれるところですが、個人的には尿路感染症や胆道感染などでソースコントロールがついていて重症でなく、短期間で治療が済むような場合には第三世代セフェムで治療完遂することもあります(プラチナマニュアル第8版にもそう書いてありますね)。
まとめ
今回は、臨床現場で遭遇するAmpCβラクタマーゼについて解説しました。
ポイントは、“Enterobacter属菌、Klebsiella aerogenes, Citrobacter freundiiが、薬剤感受性でCTXやCTRXに対して”S(感性)”の場合、第3世代セフェムを使用するのは原則避ける”です。
Species-specific mutation rate for ampC depression in Enterobacterales with chromosomally encoded inducibule AmpC β-lactamase. J Antimicrob Chemother 2018;73:1530-6. PMID: 29566147.
IDSA 2023 guidance on the treatment of antimicrobial resistant gram-negative infections. Clin Infect Dis 2023 ciad4248. PMID: 37463564

コメント